
ENERGÍA DE IONIZACIÓN
Definición: Es la energía necesaria para arrancar un electrón de un átomo neutro y formar un catión (ión positivo).
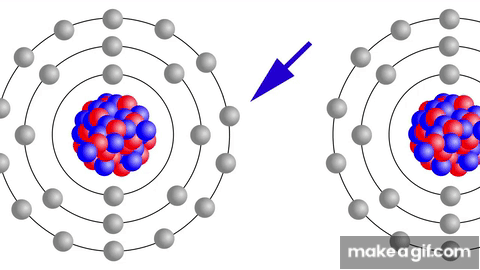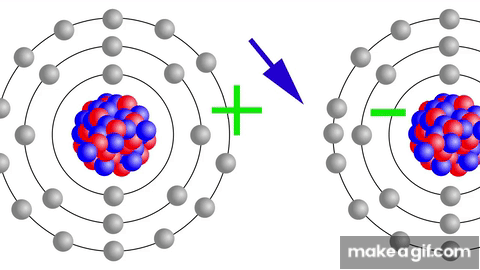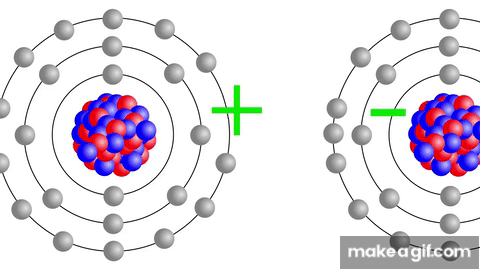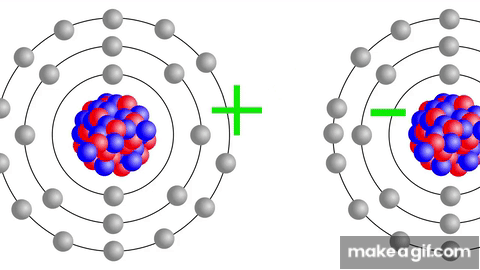
Tendencias en la tabla periódica:
En un grupo: La energía de ionización aumenta al subir en el grupo (disminuye el número atómico).
En un período: La energía de ionización aumenta de izquierda a derecha (aumenta el número atómico).
Ejemplo: El litio tiene mayor energía de ionización que el potasio.

JUEGA Y APRENDE
.jpg)
AFINIDAD ELECTRÓNICA
Definición: Es la energía liberada cuando un átomo neutro en estado gaseoso acepta un electrón, formando un anión.
Tendencias en la tabla periódica:
En un grupo: la afinidad electrónica se incrementa al aumentar el número atómico.
En un período (de izquierda a derecha): la afinidad electrónica aumenta conforme disminuye el número atómico.

Los elementos hacia la derecha del período, como los halógenos, tienen una mayor tendencia a aceptar electrones para completar su capa de valencia.
Da click para ver el video 👀

